多个肿瘤标志物同时检测可以大大提高癌症诊断的准确性和可靠性,然而目前报道的多个肿瘤生物标志物同时检测的工作大多集中在检测单一类型标志物(如,两种蛋白质或两种核酸),这在某种程度上限制了多种类型标志物的研究。原位同时获取细胞内不同空间位置分布的两种不同类型肿瘤标志物(一种蛋白质和一种核酸) 信息不仅能够实时显示癌细胞的生理状态并且消除假阴性或假阳性信号,还可以更准确的定位癌症的病变位点信息,对于癌症的精准早期诊断至关重要。
近期,青岛科技大学罗细亮教授和徐升豪副教授课题组,在前期荧光纳米团簇和肿瘤标志物多组分检测的工作基础上(Anal. Chem. 2019, 91, 13947-13952; Anal. Chem. 2018, 90, 4039-4045; Anal. Chem. 2014, 86, 11634-11639; Chem. Commun. 2020, 56, 4074-4077; ACS Appl. Mater. Interfaces 2020, 12, 373-379; Biosens. Bioelectron. 2017, 97, 203-207), 以单链DNA修饰的两种不同荧光颜色的金纳米簇(Au NCs)为能量供体,以聚多巴胺包覆的金纳米双锥体(Au NBPs@PDA)为能量受体,构建了一种诊疗一体化多功能纳米平台,实现了单一波长激发下同时检测两种位于细胞内不同空间分布的不同类型肿瘤标志物(MUC1和miRNA-21)以及荧光介导的光热治疗。MUC1与其适配体的竞争性结合导致MUC1适配体标记的Au NCs (610 nm)从Au NBPs@PDA表面分离,开启红色荧光。同时,miRNA-21与其互补单链DNA的杂交触发Au NCs (515 nm)的绿色荧光。基于此,实现了细胞内不同空间分布的两种肿瘤生物标志物的同步原位多层成像(图1)。
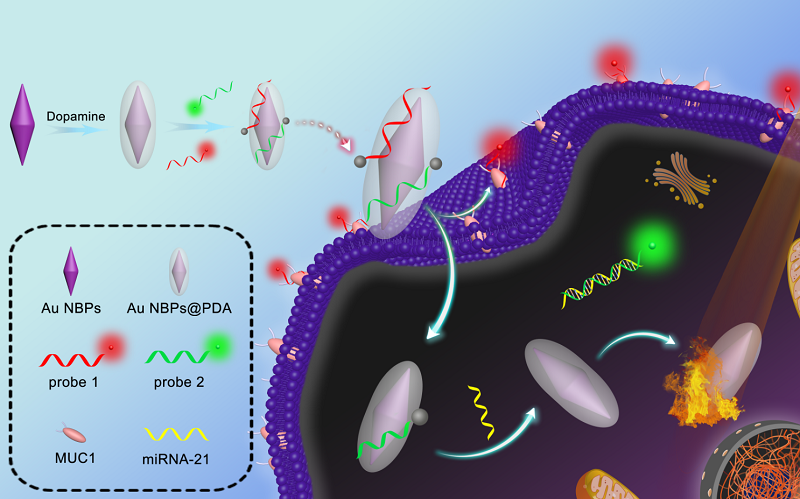
图1 基于核壳结构的多功能纳米材料用于细胞内不同空间分布的两种不同类型肿瘤标志物同时成像检测示意图。图片来源:Anal. Chem.
该方法不仅可以实现MUC1和miRNA-21表达水平不同的3个细胞系(MCF-7、HepG2和L02细胞)检测,还可以实现不同抑制剂处理的癌细胞中的MUC1和miRNA-21的检测(图2)。
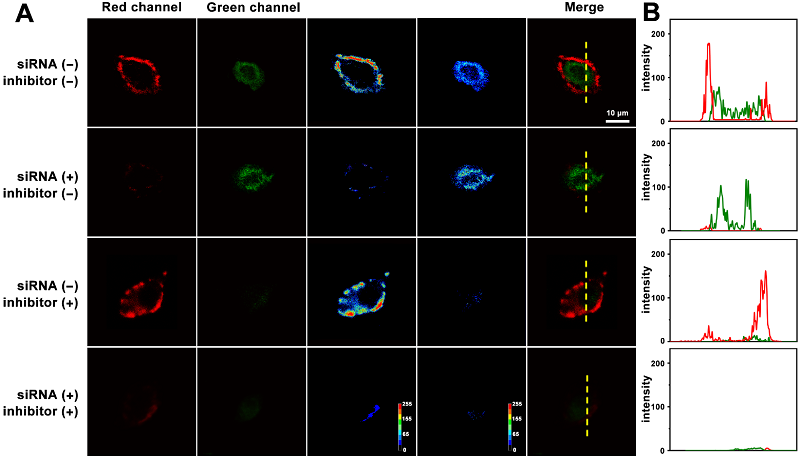
图2 基于核壳结构的多功能纳米材料用于不同抑制剂处理癌细胞中MUC1和miRNA-21的检测同时成像图。图片来源:Anal. Chem.
此外,Au NBPs@PDA相比于纯Au NBPs具有更高的光热特性,能够更有效地杀死癌细胞(图3),显示出了这种诊疗一体化平台在精确诊断和肿瘤治疗方面的应用潜力。
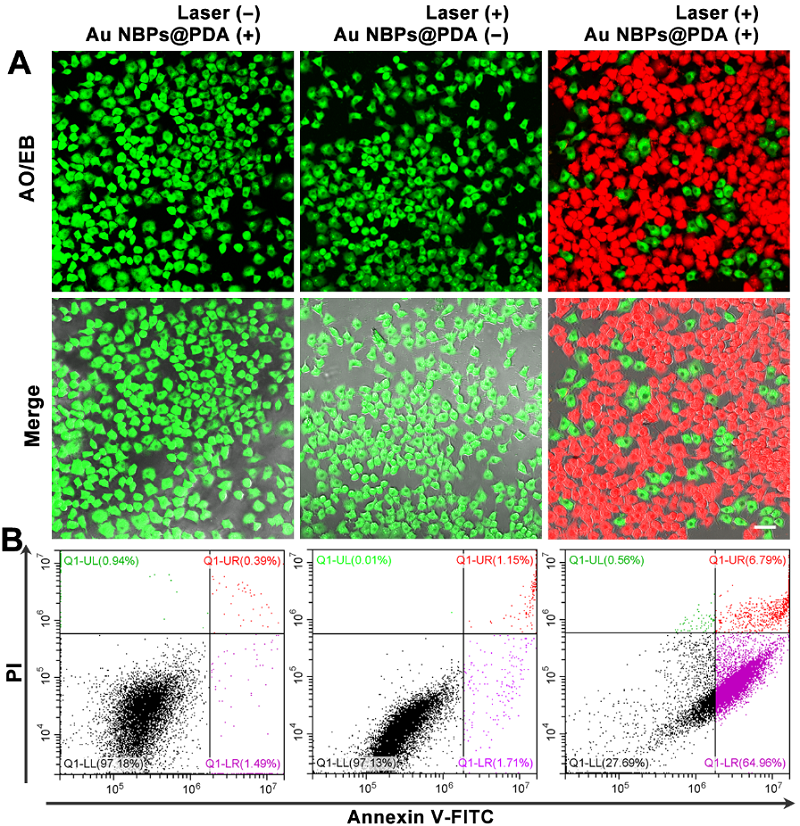
图3 基于核壳结构的多功能纳米材料用于癌细胞的光热治疗结果。
图片来源:Anal. Chem.
该研究成果近期发表在美国化学会分析化学领域顶级期刊《Analytical Chemistry》上,文章的第一作者是2018级硕士研究生王军,通讯作者是徐升豪副教授和罗细亮教授。该研究得到国家自然科学基金(21675093、21505081、21974075)、山东省属优青项目(ZR2019YQ13)、山东省高校优秀青年创新团队项目(2019KJC007)和泰山学者建设专项基金(ts20110829)的资助支持。
论文链接:https://pubs.acs.org/doi/10.1021/acs.analchem.0c03669
Jun Wang, Yuhuan Gao, Pingping Liu, Shenghao Xu,* and Xiliang Luo*, Core−Shell Multifunctional Nanomaterial-Based All-in-One Nanoplatform for Simultaneous Multilayer Imaging of Dual Types of Tumor Biomarkers and Photothermal Therapy, Anal. Chem., 2020, DOI: 10.1021/acs.analchem.0c03669
