背景介绍:
生物分子的亚细胞水平原位成像能够为疾病的临床精准早期诊断提供有效的定位指导等信息。然而,亚细胞水平的精确分子成像仍然存在两个不可忽视的缺陷:(1)大多数与疾病相关的生物分子不仅在肿瘤细胞中高表达,在正常细胞中也有不可忽略的表达水平并且可以通过信号放大策略会被同步放大,因而常规分子成像策略由于其“always-on”的传感模式在正常细胞中也会产生信号响应导致较差信噪比;(2)荧光染料的光漂白导致灵敏度不足会降低亚细胞成像分辨率。因此,开发亚细胞水平具有更高灵敏度的精确肿瘤特异性分子成像方法仍然具有重大挑战。
针对上述科学问题,青岛科技大学徐升豪、罗细亮课题组基于前期精准分子成像策略工作的基础上(Anal. Chem.2023, 95,9388–9395;Anal. Chem.2023, 95, 3525-3531;Anal. Chem.2022, 94, 16887-16893;Anal. Chem.2022, 94, 14467-14474;Anal. Chem.2022, 94, 5399-5405;Anal. Chem.2021, 93, 12329-12336),开发了一种由光和内源性APE1酶触发的等离子体天线用于亚细胞水平肿瘤细胞特异性精准分子成像(图1)。同时,结合等离子体增强荧光(PEF)技术的引入,有效减少了亚细胞水平的非肿瘤信号泄漏,显著提高了肿瘤/正常细胞的鉴别率,显示了这种由光和内源性酶触发的等离子体天线在亚细胞水平上用于肿瘤细胞特异性分子成像的广阔前景。
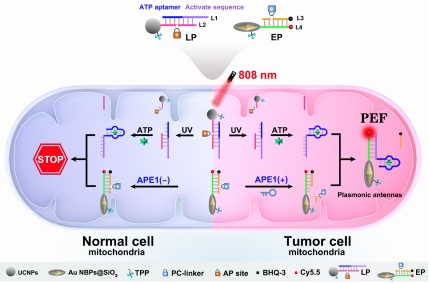
图1近红外光和内源性APE1酶触发的等离子体天线用于亚细胞水平肿瘤细胞特异性分子成像示意图。图片来源:Chem. Sci.
光激活可以决定何时激活而内源性酶激活可以决定在何地激活,这种设计可以确保在亚细胞水平上实现肿瘤细胞特异性分子成像。本实验中将上转换纳米颗粒作为光转换开关确保近红外光的定时激活,修饰有酶响应DNA探针的包覆二氧化硅的金纳米双锥体确保实现肿瘤细胞内特异性激活,并且基于金纳米双锥体的荧光增强能力显著提升检测灵敏度(图2)。
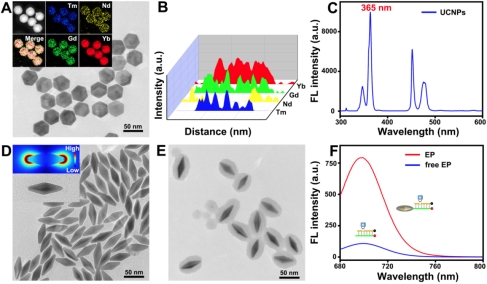
图2近红外光和内源性APE1酶触发的等离子体天线用于亚细胞水平肿瘤细胞特异性分子成像示意图。图片来源:Chem. Sci.
与传统策略相比,这种双激活的等离子体天线对肿瘤/正常细胞的区分率达到约11.57倍,有效地降低了“非肿瘤”信号泄漏,实现了亚细胞水平的肿瘤特异性分子成像并显著提高了成像的空间分辨率(图3)。
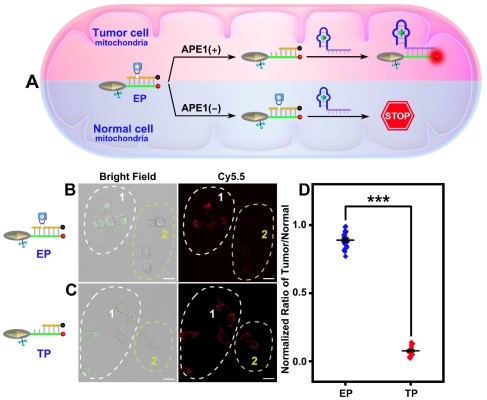
图3近红外光和内源性APE1酶触发的等离子体天线对混合培养细胞中肿瘤/正常细胞的辨别。图片来源:Chem. Sci.
该研究成果近期以题为《Light and endogenous enzyme triggered plasmonic antennas for accurate subcellular molecular imaging with enhanced spatial resolution》发表在化学领域顶级期刊Chemical Science上,文章的第一作者是2021级硕士研究生陈书伟,通讯作者是徐升豪副教授和罗细亮教授。该研究得到国家自然科学基金(21505081、21974075)、山东省省属优青(ZR2019YQ13)、山东省自然科学基金面上项目(ZR2023MB110)、山东省高校优秀青年创新团队项目(2019KJC007)和山东省泰山学者建设专项基金(ts20110829)的资助支持。
论文信息:Shuwei Chen, Yue Yin, Xiaozhe Pang, Congkai Wang, Lei Wang, Junqi Wang, Jiangfei Jia, Xinxue Liu, Shenghao Xu* and Xiliang Luo*, Light and endogenous enzyme triggered plasmonic antennas for accurate subcellular molecular imaging with enhanced spatial resolution,Chem. Sci.,2023, DOI:https://doi.org/10.1039/D3SC05728C
